Hintergrundwissen Scale
Scale und DSL
Mittels der Differential (Dynamic) Scale Loop (DSL) wird das Ablagerungsverhalten auskristallisierender Mineralsalze untersucht. In der DSL werden zwei ionische Lösungen miteinander gemischt und durch das Überschreiten des Löslichkeitsproduktes mindestens eines Salzes kommt es zur Kristallbildung. Die Kristalle wachsen u.a. an den Wänden der Testkapillare und setzen diese zu, d.h. der Durchmesser der Kapillare sinkt. Aufgrund der vorherrschenden Versuchsbedingung liegt im Inneren der Testkapillare eine Umgebung vor, die eine laminare Strömung des Fluids bedingt.
Für laminare Strömungen gilt das Gesetz nach Hagen-Poiseuille:
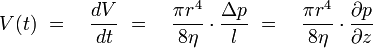
Umgeformt nach Δp ergibt sich:
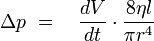
Und zusammengefaßt da Volumenstrom dV/dt, Viskosität η und Kapillarlänge l = const:
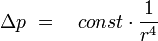
Somit ist ersichtlich, dass Druckänderungen von der vierten Potenz des Radius abhängig sind, bereits geringste Änderungen des Kapillardurchmessers durch Ablagerungen bedingen bereits eine deutliche Druckänderung. Diese wird in der DSL gemessen und gibt an, zu welchem Zeitpunkt sich Ablagerungen in der Testkapillare zu bilden beginnen.
Das Messprinzip sieht vor, dass ein zu testender Scale-Inhibitor (SI) in hoher Konzentration mit einer der ionischen Lösungen in das Gemisch eingebracht wird und dann stufenweise die Konzentration des SI reduziert wird bis es zu einem Druckanstieg über die Testkapillare kommt. Die dann aktuelle SI-Konzetration ist somit gerade nicht mehr wirksam bzw. die letzte zuvor verwendete SI-Konzentration ist noch ausreichend, um eine Scale-Bildung wirksam zu verhindern. Messungen unter verschiedenen Temperatur-, Druck- und Volumenstrombedingungen erlauben qualitative und quantitative Vergleiche unterschiedlicher Inhibitoren sowie die Optimierung der Bedingungen für einen speziellen SI.
Scale
Der Begriff Scale (dt.: Kesselstein) umfasst in der Erdölfördertechnik alle anorganischen mineralischen Ablagerungen. Zumeist enthalten sind die Carbonate und Sulfate der Erdalkalimetalle Calcium, Strontium und Barium. Auch treten exotischere Scales wie Metallcarbonate (z.B. FeCO3), Sulfide (z.B. FeS, ZnS, PbS), Silikate und Phosphate (Ca3(PO4)2) auf.
Damit es zu Ablagerungen kommt müssen einige Kriterien erfüllt werden:
Das Löslichkeitsprodukt eines Salzes muss überschritten werden durch Änderungen der lokalen Bedingungen, d.h. Temperatur, Druck, pH-Wert oder Wasserzusammensetzung.
Kristallisationskeime müssen vorliegen, ansonsten bleibt die Lösung übersättigt und es kommt zu keiner Ausfällung oder nur zu amorphen Niederschlägen, welche zunächst kein Problem darstellen.
Das Kristallwachstum muss möglich sein, es darf keine zu große kinetische Hemmung vorliegen.
Adhäsion zwischen Kristallen und Wand, d.h. Kristallwachstum muss an der Gefäßwand (Bohrleitung, Pipeline) ermöglicht sein.
Tritt mindestens eine der Bedingungen nicht ein, so kann die Bildung von Scale verhindert oder zumindest stark verzögert werden. Zu jeder Bedingung sind für die industrielle Förderung Lösungsansätze gegeben. So können z.B. störende Ionen herausgefiltert werden sowie Druck, Temperatur und pH-Wert in gewissen Bereichen variiert werden. Auch nutzt man Scale-Inhibitoren, um die Bildung und Ablagerung zu stören indem z.B. durch Chelatbildner Störionen von vorn herein maskiert werden oder Chemikalien durch die der Kristallisationsprozeß gestört/verhindert wird. Je nach den Bedingungen vor Ort sind dabei teils sehr verschiedene Verfahrensweisen möglich. Bereits erfolgte Ablagerungen lassen sich meist wieder entfernen. Dabei ist die Zusammensetzung des Scales entscheidend für die zu wählenden Bedingungen. Im Allgemeinen erfolgt die Auflösung über deutliche pH-Änderungen oder zugesetzte Spezialchemikalien.
Für die Entfernung und Vermeidung der am häufigsten auftretenden Scales CaCO3 und BaSO4 siehe Abschnitt Calciumcarbonat / Bariumsulfat.
Generell ist allerdings die Vermeidung von Scale aus ökonomischen Gründen eindeutig vorzuziehen, da dies im laufenden Betrieb (kontinuierliche oder diskontinuierliche Zugabe von Spezialchemikalien) möglich ist und somit die laufende Förderung nicht behindert.
Löslichkeit
Die Löslichkeit L gibt an, wie viel eines Stoffes in einem bestimmten Lösungsmittel gelöst werden kann. Das sich ergebende Stoffgemisch ist nach dem Lösen einphasig und homogen.
Die quantitative Löslichkeit kann in verschiedenen Einheiten angegeben werden. Üblicherweise werden die Angaben von Gewicht (g/kg), Volumen (L, mL) oder Stoffmenge (mol) des gelösten Stoffes in Bezug auf Gewicht (g/kg) oder Volumen (L, mL) des Lösungsmittels verwendet.
Die qualitative Löslichkeit ist aus thermodynamischen Gründen für jeden Stoff in jedem Stoff theoretisch gegeben. In der Praxis werden in Bezug auf ein Lösungsmittel Einteilungen wie "schwer löslich", "bedingt löslich" und "gut"- bzw. "unbegrenzt löslich" getroffen, diese Bereiche haben fließende Übergänge und sind willkürlich gesetzt. Wie gut ein Stoff in einem Lösungsmittel löslich ist, hängt sehr stark von den jeweiligen molekularen Eigenschaften ab.
Löslichkeitsgrenze
Viele Substanzen haben in Lösungsmitteln eine obere Löslichkeitsgrenze. Bis zu dieser Grenze steigt die Konzentration des Stoffes mit der zugesetzten Menge an, bei Erreichen der Grenze bleibt die Konzentration auch bei steigendem Zusatz konstant, es bildet sich eine zweite Phase z.B. ein Bodensatz bei zugesetzten Feststoffen aus. Zwischen den Phasen stellt sich ein Mischungsgleichgewicht ein. Die Löslichkeitsgrenze ist temperaturabhängig zusätzlich bei Gasen auch druckabhängig, daher gelten angegebene Löslichkeiten im allgemeinen nur für Standardbedingungen (pStd = 1013 hPa, tStd = 20 °C oder 25 °C).
Löslichkeitsprodukt
Das Löslichkeitsprodukt KL eines reinen, dissoziierenden Stoffes im reinen Lösungsmittel ist das Produkt der Konzentrationen der einzelnen dissoziierten Bestandteile in Potenz ihres stöchiometrischen Faktors an der Löslichkeitsgrenze.
So ist z.B. das Löslichkeitsprodukt des vollständig dissoziierenden Salzes AxBy:
KL(AxBy) = cx(A) * cy(B) [molx+y/Lx+y]
Sättigungsgrenze
Eine Übersättigung einer Lösung liegt vor, wenn die Löslichkeit zwar überschritten wird, die Bildung einer zweiten Phase jedoch aus kinetischen Gründen (fehlende Aktivierungsenergie) oder durch ungenügende Diffusionsprozesse verhindert wird. Dieser Zustand wird meist durch Abkühlung einer gesättigten Lösung erreicht. Trotz des thermodynamisch ungünstigeren Zustandes bleibt die Lösung jedoch durch die Hinderungen einphasig in einem metastabilen Gleichgewichtszustand. Erst durch Energieeintrag oder z.B. das Hinzufügen von Kristallisationskeimen wird das Gleichgewicht derartig gestört, dass sich das thermodynamisch günstigere Gleichgewicht einstellen kann und es zu einer Phasentrennung kommt.
Kristallisationskeime
Kristallisationskeime sind feindisperse feste Partikel innerhalb der fluiden Phase oder Störungen an der Phasengrenze z.B. der Gefäßwand. Diese erleichtern das Ausbilden einer neuen Phase in einer übersättigten Lösung. Dabei ist unwichtig, ob es eine fest-flüssig-Trennung (Kristallisation) oder eine flüssig-flüssig-Phasentrennung ist. Für die Ausbildung einer neuen Phase setzt sich die freie Enthalphie aus dem Term für den thermodynamischen Volumenanteil und dem entgegengesetzten kinetischen Term für die Oberflächenarbeit zusammen. Für sehr kleine Kristalle überwiegt der Oberflächenterm, so dass das Wachstum des Kristalles kinetisch behindert bis verhindert wird. Werden Kristallisationskeime zu der übersättigten Lösung hinzugefügt, so wird die kinetische Hemmung umgangen und der thermodynamische Term überwiegt, es kommt zum Kristallwachstum.
Im Falle der Untersuchungen von Ablagerungen aus strömenden Medien in Pipelines sind die Kristallisationskeime Störungen in der Oberfläche der Pipelines, z.B. die fertigungsbedingten mikroskopischen Unebenheiten der Oberfläche oder bereits vorhandene chemisch-physikalische Ablagerungen. An diesen Stellen wird bei übersättigten Lösungen das metastabile Gleichgewicht der Phase gestört und es kommt hier zur Kristallisation. Durch das schnelle Kristallwachstum sinkt der Pipelinedurchmesser und es kommt zu einem messbaren Druckansteig zwischen Pipellineein- und -ausgang. Das im strömenden Medium ebenfalls stattfindende Auskristallisieren des gelösten Stoffes ist hier unerheblich, da die Fließeigenschaften sich nicht bzw. nur geringfügig verändern und somit keine Unterschiede zwischen dem einphasigen Gemisch und einer zweiphasigen Suspension feststellbar sind.
Calciumcarbonat
Summenformel: CaCO3
Zersetzung bei 825 °C, CaCO3 → CaO + CO2 (Kalkbrennen)
Wasserunlöslich, KL = 5 * 10-9 mol²/L² (25 °C)
Löslich in sauren, wäßrigen Lösungen
Fällt Calciumcarbonat aus übersättigten Lösungen aus, so bildet sich zunächst ein amorpher Niederschlag, der erst langsam in die kristalline Form des Calcits oder bei Temperaturen >30 °C des Aragonits übergeht.
Scale-Vermeidung: über die Temperatur läßt sich das Löslichkeitsprodukt beeinflussen, jedoch bieten die Einflüsse von pH-Wert und Druck deutlich stärkere Spielräume über den Eingriff in das Hydrogencarbonatgleichgewicht. Auch können Calciumionen über sogenannte Chelatbildner maskiert werden. Dabei werden diese Ionen in Komplexverbindungen gebunden und dadurch aus dem Lösungsgleichgewicht entfernt.
Scale-Entfernung: Beide oben erwähnten Kristallformen sind recht gut durch saure Lösungen angreifbar und lassen sich leicht durch z.B. schwach konzentrierte Essig-, Salz- oder Zitronensäure wieder lösen:
CaCO3 + H3O+ → Ca2+ + HCO3-.
Bariumsulfat
Summenformel: BaSO4
Zersetzung bei 1580 °C, BaSO4 → BaO + SO2 + ½ O2
Wasserunlöslich, KL = 1,08 * 10-10 mol²/L² (25 °C)
Bariumsulfat ist chemisch sehr beständig, es widersteht Laugen und nahezu allen Mineralsäuren, zeigt jedoch in konzentrierter Schwefelsäure eine gute Löslichkeit. Für eine technische Umsetzung ist diese Reaktionsbedingung allerdings wenig geeignet.
Ablagerungen treten durch das sehr geringe Löslichkeitsprodukt im Moment der Mischung von Barium- und Sulfathaltigem Wasser auf.
Scale-Vermeidung: durch Änderung der Temperatur kann die Löslichkeit in gewissem Umfang beeinflußt werden, mittels Scale-Inhibitoren werden die Sulfationen maskiert (Chelatbildner), die Kristiallisation gehemmt.
Scale-Entfernung: Die Entfernung von Bariumsulfat ist über Säuren und Laugen aufgrund dessen Beständigkeit nicht möglich. Daher setzt man Chelatbildner (z.B. EDTA, DTPA, HEIDA) ein. Durch diese wird das BaSO4 in eine lösliche Form überführt und abgebaut. Dieser Abbau ist im allgemeinen deutlich langsamer als die saure Auflösung von Carbonatablagerungen.
Carbonat-Hydrogencarbonatgleichgewicht, Kesselstein
CaCO3 + H2O + CO2 → Ca(HCO3)2
In kohlensäurehaltigem Wasser bildet sich ein Gleichgewicht zwischen sehr schlecht löslichem Calciumcarbonat und dem deutlich besser löslichen Calciumhydrogencarbonat. Über den CO2-Gehalt ist somit die Verschiebung des Gleichgewichtszustandes möglich. Bei Erwärmung der Lösung sinkt die Löslichkeit des Kohlendioxids in Wasser. Das Gleichgewicht verschiebt sich auf die linke Seite der Reaktionsgleichung, so dass schließlich Calciumcarbonat aus der Lösung ausfällt (Prinzip von Le Chatelier). Das ausfallende Calciumcarbonat kristallisiert u.a. an Kristallisationskeimen an den Wänden des Reaktionsgefäßes aus, so dass sich bei längerer Einwirkzeit oder bei häufigen Wiederholungen des Reaktionszyklus eine Kalkschicht ablagert, der so genannte Kesselstein.


